Com base em uma metodologia ativa centrada em modelagem, resolução colaborativa de problemas e uso de recursos digitais abertos, o plano favorece a construção de representações mentais sólidas sobre peptídeos e a conexão com outras áreas, em especial Biologia e Matemática (contagem de ligações e combinações possíveis).
Ao final, o professor terá um roteiro completo para conduzir uma aula de 50 minutos clara, dinâmica e interdisciplinar, incluindo sugestões de avaliação formativa e um resumo pronto para ser compartilhado com os alunos.
Objetivos de aprendizagem
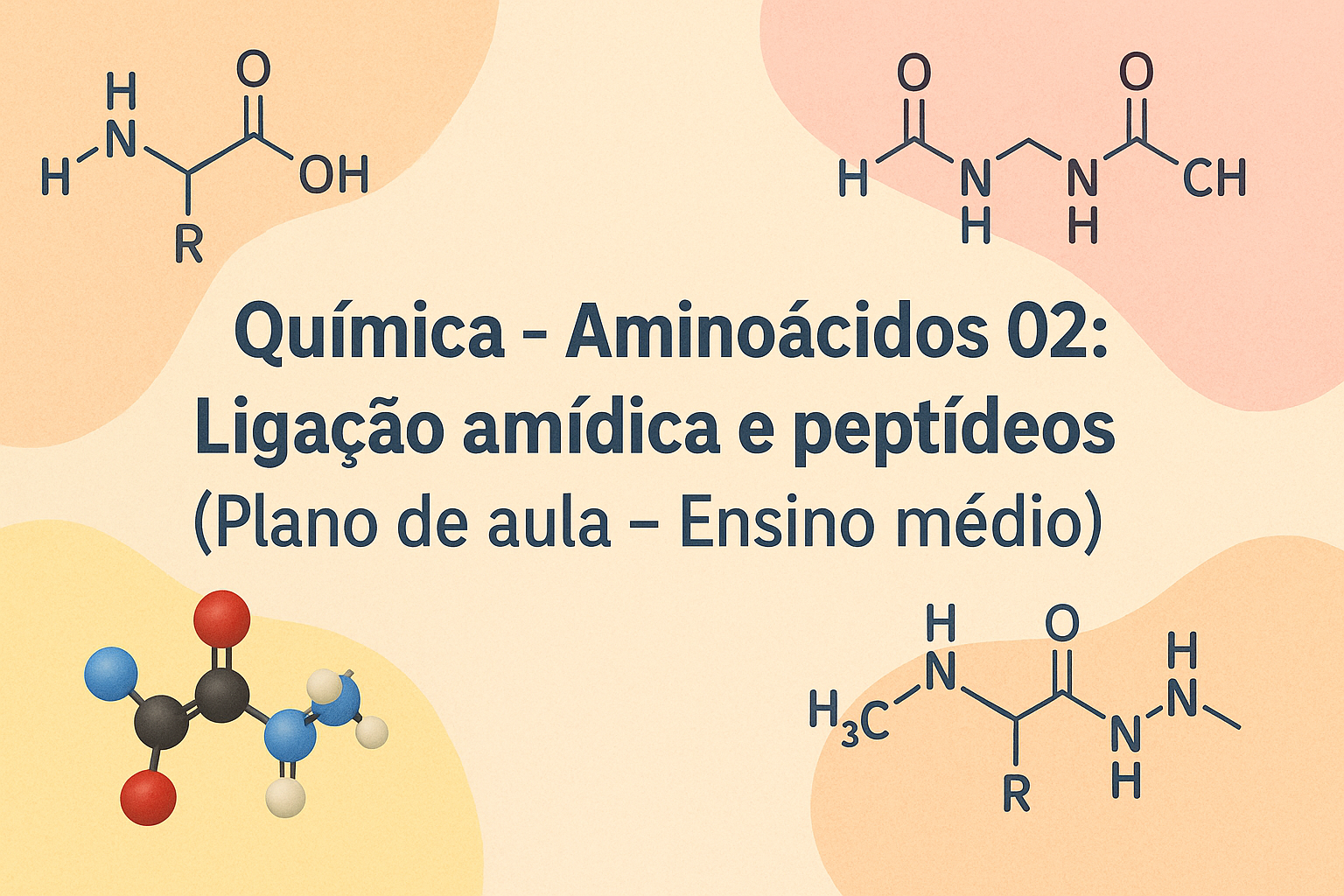
Ao final desta aula, os estudantes deverão ser capazes de reconhecer a estrutura geral de um aminoácido, identificando corretamente os grupos funcionais essenciais: grupo amino, grupo carboxila, hidrogênio e cadeia lateral (grupo R) ligados ao carbono alfa. Espera-se que consigam diferenciar, em representações planas e espaciais, o que muda de um aminoácido para outro e o que permanece constante, relacionando essas diferenças estruturais às propriedades físico-químicas básicas, como polaridade e possibilidade de formação de ligações de hidrogênio.
Outro objetivo central é que os alunos compreendam, em nível molecular, como se forma uma ligação amídica (peptídica) entre dois aminoácidos por meio de uma reação de condensação. Eles deverão ser capazes de esquematizar o mecanismo geral dessa reação, indicando quais átomos participam diretamente da formação da nova ligação C–N e de onde provém a molécula de água liberada. Além disso, espera-se que reconheçam a direção da cadeia peptídica, distinguindo as extremidades N-terminal e C-terminal.
Os estudantes também deverão ser capazes de representar e nomear peptídeos simples, construindo cadeias com 2 a 4 aminoácidos e registrando-as usando abreviações de três letras ou uma letra, conforme apropriado. A partir dessas representações, deverão conseguir contar o número de ligações peptídicas presentes em um dado peptídeo e relacionar a quantidade de ligações ao número de aminoácidos participantes, fazendo conexões com conceitos matemáticos de sequências e combinações.
Em termos de contextualização, a aula tem como objetivo que os alunos associem as ligações peptídicas a processos biológicos reais, como digestão de proteínas, ação de enzimas proteolíticas e funcionamento de hormônios peptídicos. Espera-se que consigam descrever, em linguagem acessível, por que a quebra e a formação dessas ligações são cruciais para o metabolismo e para a estrutura das proteínas, reconhecendo exemplos em alimentos, medicamentos e materiais do cotidiano.
Por fim, pretende-se desenvolver competências de raciocínio científico e trabalho colaborativo. Os alunos deverão interpretar modelos moleculares físicos ou digitais, argumentar em grupo sobre possíveis estruturas de peptídeos e registrar conclusões de forma organizada. Como resultado, espera-se que demonstrem maior autonomia para analisar diagramas de moléculas orgânicas, justificar suas respostas com base em evidências estruturais e utilizar uma terminologia básica de bioquímica de forma correta e segura.
Materiais utilizados e integração interdisciplinar
Para concretizar o estudo de ligações amídicas e peptídicas, o plano de aula propõe um conjunto de materiais simples, acessíveis e com forte potencial visual. Podem ser utilizados kits de modelagem molecular escolares, bolinhas de isopor ou massa de modelar em duas cores (para representar grupos amino e carboxila), palitos de dente ou conectores plásticos (simbolizando as ligações) e cartões impressos com fórmulas estruturais de aminoácidos comuns, como glicina, alanina e serina. Recursos digitais, como simuladores de moléculas em 3D e animações curtas sobre síntese proteica, complementam a abordagem, permitindo que os estudantes alternem entre representações concretas e abstratas.
Além dos materiais físicos, é recomendável o uso de um projetor ou lousa digital para exibir esquemas passo a passo da reação de condensação que forma a ligação peptídica. Planilhas simples, preparadas previamente, podem ajudar na contagem do número de ligações em cadeias de diferentes comprimentos, favorecendo o raciocínio lógico-matemático. Quando houver acesso à internet, o professor pode indicar plataformas abertas de visualização de proteínas e peptídeos, permitindo que os alunos conectem o modelo simplificado de sala de aula com estruturas reais encontradas em livros, exames e artigos de divulgação científica.
A integração interdisciplinar aparece de forma natural, sobretudo com a Biologia. Ao discutir peptídeos, o professor pode articular o conteúdo com temas como digestão de proteínas, atuação de enzimas proteolíticas e estrutura básica de hormônios peptídicos, aproximando o estudo químico da realidade do corpo humano. Um momento da aula pode ser dedicado a analisar rótulos de suplementos proteicos ou alimentos ricos em proteínas, relacionando massas molares aproximadas, tamanho médio de cadeias e papel biológico desses compostos, conectando conceitos químicos, biológicos e de educação alimentar.
Com a Matemática, a ponte se dá principalmente por meio da contagem combinatória e da proporcionalidade. Os alunos podem ser desafiados a calcular quantas ligações peptídicas existem em um peptídeo formado por um dado número de aminoácidos, ou a estimar quantas sequências diferentes são possíveis com um conjunto limitado de monômeros, introduzindo, de forma intuitiva, noções de arranjos e permutações. Atividades em grupo que envolvem a construção de tabelas e gráficos simples ajudam a interpretar essas relações numéricas e a visualizar padrões.
Outras áreas também podem ser mobilizadas, como Língua Portuguesa, na leitura crítica de textos de divulgação científica sobre proteínas, ou História, na contextualização de descobertas sobre estrutura de peptídeos e proteínas ao longo do século XX. Ao final, o professor é incentivado a retomar explicitamente essas conexões, pedindo que os estudantes identifiquem, em pequenos relatos escritos ou apresentações orais, quais saberes de Biologia, Matemática e outras disciplinas foram acionados para compreender o funcionamento e a representação das ligações amídicas e dos peptídeos.
Metodologia ativa e justificativa pedagógica
A escolha por uma metodologia ativa neste plano de aula baseia-se na necessidade de ir além da memorização de fórmulas e definições, promovendo a compreensão real da estrutura e do comportamento dos aminoácidos e peptídeos. Em vez de apenas assistir à explicação do professor, os estudantes são colocados no centro do processo, manipulando modelos, discutindo hipóteses e construindo representações próprias das ligações amídicas. Isso favorece a aprendizagem significativa, pois o novo conteúdo se ancora em situações concretas, como digestão de proteínas, ação de medicamentos e funcionamento de enzimas.
Do ponto de vista pedagógico, a abordagem dialoga com teorias construtivistas e sociointeracionistas, nas quais o conhecimento é construído ativamente pelo aluno em interação com colegas, professor e materiais de apoio. Ao propor momentos de investigação guiada, resolução de problemas em pequenos grupos e sínteses coletivas, o professor atua como mediador, oferecendo pistas, perguntas desafiadoras e feedback constante, em vez de se limitar ao papel de transmissor de informações. Essa postura favorece o desenvolvimento de habilidades de argumentação, pensamento crítico e autonomia intelectual.
A opção por modelagem molecular simples (com kits físicos, materiais de baixo custo ou simuladores digitais) tem justificativa específica: a visualização tridimensional das moléculas e das ligações peptídicas reduz a abstração típica desse conteúdo e ajuda estudantes a relacionarem fórmulas planas a estruturas espaciais. Ao construir uma cadeia peptídica, o aluno consegue perceber de maneira concreta onde ocorre a reação de condensação, como se forma a ligação amídica e por que a liberação de água é uma consequência natural do processo. Isso contribui para a internalização de conceitos que voltarão em temas como proteínas, enzimas e DNA.
Também há uma intencionalidade clara na interdisciplinaridade com Biologia e Matemática. Ao conectar a formação de peptídeos com digestão, síntese proteica e mecanismos enzimáticos, o estudante entende que a Química não é uma disciplina isolada, mas uma linguagem que explica fenômenos biológicos. Simultaneamente, o uso de problemas envolvendo contagem de aminoácidos, número de ligações peptídicas e combinações possíveis de sequências estimula o raciocínio lógico e o uso prático de conteúdos matemáticos, fortalecendo competências gerais previstas na Base Nacional Comum Curricular.
Por fim, a adoção de recursos digitais abertos e atividades colaborativas justifica-se pela ampliação do acesso ao conhecimento e pelo desenvolvimento de competências digitais e socioemocionais. Plataformas de simulação, vídeos curtos e infográficos permitem a revisitação do conteúdo fora do tempo de aula, facilitando a aprendizagem em ritmos diferentes. O trabalho em grupo, por sua vez, estimula a escuta ativa, o respeito a diferentes pontos de vista e a corresponsabilidade pelo processo de aprendizagem, aspectos essenciais para formar estudantes críticos, participativos e preparados para desafios acadêmicos e profissionais futuros.
Desenvolvimento da aula: preparo prévio do professor
Antes da aula, o professor deve revisar os conceitos fundamentais de aminoácidos trabalhados no encontro anterior, garantindo clareza sobre a estrutura geral (grupo amino, grupo carboxila, carbono alfa e cadeia lateral). É importante selecionar previamente exemplos de aminoácidos representativos, como glicina, alanina e lisina, que permitam discutir tanto aspectos estruturais quanto propriedades ácido-base. Essa revisão teórica servirá de base para explicar, com segurança, o mecanismo simplificado de formação da ligação amídica (peptídica) por meio de reação de condensação.
Também é recomendável que o docente prepare materiais visuais que facilitem a representação em nível molecular. Isso pode incluir projeções de estruturas em 2D e 3D, esquemas de reação destacando a saída da molécula de água e a formação da nova ligação C–N, além de modelos físicos simples (bolas de isopor, peças de montagem ou kits moleculares, se disponíveis). Quando possível, o professor deve organizar previamente links para recursos digitais abertos, como simuladores e animações curtas, testando-os antes da aula para evitar problemas técnicos.
Como a proposta privilegia metodologias ativas, o professor precisa planejar os momentos de interação em grupo. Isso envolve definir questões norteadoras para discussão em duplas ou trios, como: “O que muda quimicamente quando dois aminoácidos se unem?” ou “Como a sequência de aminoácidos pode influenciar a função biológica de um peptídeo?”. Elaborar previamente uma sequência de perguntas em ordem crescente de complexidade ajuda a manter o foco da aula e a promover participação equilibrada entre os estudantes.
No que se refere à interdisciplinaridade, o professor deve alinhar a aula com conteúdos de Biologia já vistos ou em andamento, como estrutura de proteínas, enzimas e digestão. Vale preparar exemplos concretos — uma enzima digestiva, um hormônio peptídico ou um medicamento à base de pequenos peptídeos — para mostrar como as ligações amídicas aparecem em contextos reais. Esse preparo inclui pesquisar rapidamente aplicações atuais de peptídeos em saúde, cosméticos ou alimentação, selecionando casos curtos e acessíveis para comentar em sala.
Por fim, é essencial pensar com antecedência nos instrumentos de avaliação formativa que serão usados durante a aula. O professor pode preparar um pequeno roteiro de exercícios com foco em identificação de grupos funcionais, contagem de ligações peptídicas em cadeias curtas e previsão do número de moléculas de água liberadas na formação de um peptídeo. Também é útil elaborar um esquema-resumo para ser preenchido coletivamente no quadro ou em um slide final, que depois poderá ser enviado aos alunos como material de estudo, reforçando os principais conceitos trabalhados.
Desenvolvimento da aula: introdução (10 minutos)
Para iniciar o desenvolvimento da aula, o professor deve retomar rapidamente o que os estudantes já sabem sobre aminoácidos, pedindo que relembrem, em voz alta ou no quadro, a estrutura geral desses compostos: grupo amino, grupo carboxila, carbono alfa e cadeia lateral (radical). Essa ativação de conhecimentos prévios pode ser conduzida em formato de conversa guiada, com perguntas curtas e objetivas, para que os alunos se sintam seguros em participar. Nesse momento, é interessante registrar no quadro as fórmulas simplificadas, usando notações como NH2–CHR–COOH.
Em seguida, o professor apresenta o objetivo central da aula: compreender como dois aminoácidos podem se ligar por meio de uma reação química específica, formando uma ligação amídica (ou peptídica) e, a partir daí, construir peptídeos e proteínas. Essa explicitação de objetivos pode ser feita oralmente, mas também vale escrever um pequeno roteiro no quadro ou projetor, destacando tópicos como: reação de condensação, formação da ligação amídica e estrutura básica de um dipeptídeo. Assim, os estudantes entendem claramente o que se espera que eles aprendam ao final da aula.
Para contextualizar, o professor pode trazer exemplos do cotidiano que dependem de proteínas e peptídeos, como enzimas digestivas, hormônios peptídicos (por exemplo, insulina) e suplementos proteicos usados em academias. Uma breve discussão pode ser proposta: “O que todas essas substâncias têm em comum do ponto de vista químico?”. Essa pergunta estimula a curiosidade e ajuda a criar uma ponte entre o conteúdo abstrato de ligações químicas e situações concretas vividas pelos estudantes, reforçando a relevância do tema para a compreensão do próprio corpo.
Nesse momento introdutório, é recomendável que o professor apresente também os materiais que serão utilizados ao longo da aula, como kits de modelagem molecular (ou alternativas com massinha e palitos), slides com estruturas simplificadas e, se disponível, recursos digitais interativos que mostrem a formação da ligação peptídica em animações. Explicar brevemente como esses materiais serão usados prepara os alunos para uma participação mais ativa, reduzindo dúvidas operacionais durante as atividades práticas.
Por fim, antes de avançar para a explicação detalhada da reação de condensação, o professor pode propor uma atividade diagnóstica rápida, como uma pergunta de múltipla escolha projetada ou escrita no quadro, abordando a função dos grupos amino e carboxila nos aminoácidos. As respostas podem ser discutidas coletivamente, permitindo ao professor identificar possíveis concepções equivocadas e ajustar o ritmo e a profundidade da explicação. Assim, os primeiros 10 minutos da aula consolidam a base conceitual, motivam a turma e estabelecem um fio condutor claro para as próximas etapas do plano.
Atividade principal: modelagem e construção de peptídeos (30–35 minutos)
Nesta etapa central da aula, os estudantes serão organizados em grupos de 3 a 5 integrantes e receberão kits de modelagem molecular (ou materiais alternativos, como esferas de isopor, massinha, palitos e conectores) representando diferentes aminoácidos. O professor começará retomando, de forma rápida, a estrutura geral de um aminoácido (grupo amino, grupo carboxila, carbono α e cadeia lateral) e explicará que o desafio da atividade é construir peptídeos de 2 a 5 aminoácidos, identificando claramente onde ocorre a ligação amídica. O objetivo é transformar aquilo que foi visto de forma abstrata no quadro em algo manipulável, favorecendo a visualização em três dimensões.
Em seguida, cada grupo deverá escolher ao menos três aminoácidos diferentes, montar seus modelos individuais e, depois, simular a reação de condensação entre eles. O professor pode orientar passo a passo: aproximar o grupo carboxila de um aminoácido do grupo amino de outro, destacar a remoção de H2O (mostrando quais átomos saem de cada grupo) e montar a nova ligação C–N que caracteriza a ligação peptídica. É importante pedir que os estudantes indiquem, com etiquetas ou cores, a extremidade N-terminal (grupo amino livre) e a extremidade C-terminal (grupo carboxila livre) do peptídeo formado.
Para aprofundar a compreensão, o professor pode propor desafios graduais: primeiro, a montagem de um dipeptídeo simples; depois, a construção de um tripeptídeo e, por fim, de um peptídeo com quatro ou cinco aminoácidos. A cada nova cadeia formada, os grupos devem registrar em uma folha ou quadro compartilhado a sequência de aminoácidos utilizando abreviações padrão (por exemplo, Gly–Ala–Ser), o número de ligações peptídicas estabelecidas e o número de moléculas de água liberadas. Esse registro permite estabelecer, na prática, a relação matemática entre número de aminoácidos e de ligações peptídicas, reforçando a interdisciplinaridade com Matemática.
Durante a atividade, o professor deve circular pela sala, fazendo perguntas orientadoras: onde exatamente está a ligação amídica? quantos sítios reativos ainda restam nesse peptídeo? o que mudaria se invertêssemos a ordem dos aminoácidos? Essas intervenções ajudam a desconstruir ideias equivocadas, como a de que todas as partes da molécula reagem ao mesmo tempo, e estimulam a reflexão sobre estrutura e função. Se houver acesso a recursos digitais, como simuladores online ou animações de ligações peptídicas, é possível projetá-los enquanto os grupos modelam, para que os alunos comparem o modelo físico com a representação digital.
Ao final dos 30–35 minutos, cada grupo deverá apresentar rapidamente um de seus peptídeos, explicando o processo de formação, quantas moléculas de água foram liberadas e qual a orientação N-terminal → C-terminal da cadeia. O professor pode finalizar sistematizando os principais conceitos em um esquema no quadro: definição de ligação peptídica, relação entre número de aminoácidos e ligações, liberação de água e importância dessas cadeias para a formação de proteínas. Essa socialização dá fechamento à atividade prática, consolida as representações construídas e prepara o terreno para discussões posteriores sobre estrutura secundária e terciária de proteínas em aulas futuras.
Fechamento, avaliação e resumo para os alunos
Para o fechamento da aula, retome com a turma os conceitos centrais trabalhados: estrutura geral dos aminoácidos, grupos funcionais envolvidos (carboxila e amino) e o mecanismo de formação da ligação amídica, destacando a liberação de água na reação de condensação. Use o quadro, um slide ou um esquema projetado para reconstruir, junto com os estudantes, o passo a passo da formação de um dipeptídeo, pedindo que eles digam o que acontece em cada etapa. Esse momento de síntese coletiva ajuda a consolidar a linguagem química correta e a conexão com os fenômenos biológicos estudados.
Em seguida, proponha uma breve atividade de avaliação formativa, focada mais no raciocínio do que na memorização. Você pode, por exemplo, apresentar três estruturas diferentes (um aminoácido isolado, um dipeptídeo e um tripeptídeo) e pedir para que, em duplas, os alunos: (a) identifiquem onde estão as ligações amídicas, (b) contem quantas moléculas de água foram liberadas na formação da cadeia e (c) expliquem, em uma frase, por que essa ligação é tão importante para a estrutura das proteínas. Recolha algumas respostas oralmente, comentando pontos fortes e correções necessárias sem expor negativamente ninguém.
Outra possibilidade de avaliação rápida é o uso de uma lista curta de afirmações para que os estudantes indiquem se estão corretas ou não, justificando. Por exemplo: “Toda ligação entre dois aminoácidos é uma ligação amídica”, “Cada nova ligação peptídica formada consome uma molécula de água”, “A sequência de aminoácidos em um peptídeo determina suas propriedades”. Peça que expliquem em uma ou duas frases o motivo de cada escolha. Esse formato permite verificar a compreensão conceitual, identificar concepções alternativas e reforçar o vínculo entre estrutura química e função biológica.
Para o resumo final a ser compartilhado com os alunos, organize os principais pontos em uma linguagem acessível e direta. Você pode estruturar assim:
- Aminoácidos: unidades básicas das proteínas, formadas por um carbono central ligado a um grupo amino, um grupo carboxila, um hidrogênio e uma cadeia lateral (R).
- Ligação amídica (peptídica): ligação que se forma entre o grupo carboxila de um aminoácido e o grupo amino de outro, em uma reação de condensação que libera água.
- Peptídeos: cadeias de aminoácidos ligados por ligações amídicas; a sequência de aminoácidos define as propriedades da molécula e está na base da estrutura das proteínas.
- Aplicações: digestão de proteínas, ação de enzimas, estruturas corporais e produtos do cotidiano (como alguns medicamentos e cosméticos) dependem diretamente da organização de cadeias peptídicas.
Por fim, convide os estudantes a fazerem uma autoavaliação rápida do próprio aprendizado, respondendo a perguntas como: “O que eu consegui entender bem sobre ligação amídica?”, “O que ainda me gera dúvida?” e “Como esse conteúdo se conecta com Biologia e com temas de saúde?”. Sugira que registrem essas respostas no caderno ou em um formulário digital, e use esse retorno para planejar retomadas em aulas futuras. Assim, o fechamento não é apenas um encerramento de conteúdo, mas um passo importante para desenvolver autonomia, metacognição e o hábito de enxergar a Química como uma ferramenta para compreender melhor o próprio corpo e o mundo ao redor.